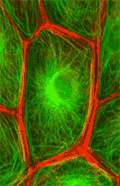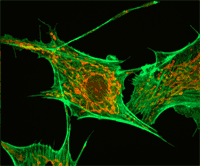
Цитоскелет.
АКТИНОВЫЕ ФИЛАМЕНТЫ
G-актин имеет участки связывания двухвал. катионов и нуклеотидов в физиологических
условиях занятые Mg и ATP. Полимеризация сопровождается гидролизом АТФ,
сто не необходимо т.к. полимеризация идет и в присутствии негидролизуемых
аналогов АТФ
Образуемый F-актин может фрагментироваться в рез. теплового движения и
соединятся конец в конец. Таким образом полимеризация состоит из нескольких
процессов: нуклеация, элонгация, диссоциация, фрагментация, стыковка -
эти процессы протекают одновременно
Актинсвязывающие белки
имеется пять мест действия белков: с мономером актина, с +концом (оперенный),
с -концом (заостренный), с боковой пов-тью. Актин-связывающие белки мб
чувствительны или нечувствительны к Ca
1 c мономером - подавляют нуклеацию профилин, фрагментин - чувств-ны к
Ca. Профилин с мономером способны надстраивать F-актин, а фрагментин нет,
блокируя и нуклеацию и элонгацию. Не чувственые к Ca ДНКазаI и белок связывающийся
с витаминомD - функционируют вне клетки
2 +конец мб блокирован кепирующими белками - блокирование элонгации и
стыковки, способствуют нуклеации - появление укороченных филаментов. Гельзолин,
виллин, фрагмин
3 -конец - инициирование нуклеации, подавление стыковки и элонгации -
увеличение числа и уменьшение длины фрагментов. Акументин в макрофагах,
бревин - сывороточный белок вызывает быстрое снижение вязкости раствора
F-актина. Оба белка не чувственны к Ca
4 несшивающие боковое связывание может как стабилизировать так и дестабилизировать
F-актин Тропомиозин (Ca-) стабилизирует, северин, виллин (Ca+) - связываясь
с F-актином разрезают его
сшивающие F-актин м-у собой с образованием геля. Такие белки индуцируют
нуклеацию. а-актин тромбоцитов, виллин, фимбрин, актиногелин из макрофагов
(Ca-)
G-актин – глобулярный | F-актин – фибриллярный, длина оборота спирали
37нм | нуклеация – соед трех G-актинов – инициация полимеризации | G>F
– полимериз + и – конца | G<F – полимериз + и деполимериз – конца –
тредмиллинг – движение F-актина | G~F –динамическое равновесие полимериз
+ и деполимериз – с затратой энергии ATP | G-актин связ с ATP и полимеризуясь
гидролизует ATP | Деполимеризация актина имеет одинаковую скорость с обоих
концов
кэпирующие белки - закрывают концы аф, предотвращ полимеризацию-деполимеризацию,
способствуют прикреплению филамента к м-не
кэпирующие-фрагментирующие белки - фрагментирует F-актин, вызывая переход
геля в золь | гельзолин 90kD активируясь Ca2+ 10-6M разрывает F-актин
и связывается с его концами |
клеточный кортекс – сеть из аф под м-ной
белки связывающие F-актин
белок M, kD локализация действие на F-актин
фасцин 55 филлоподии, ламелоподии, стресс-
фибриллы, микроворсинки, акросома
тропомиозин 2x35 укрепляет
минимиозин 150 движение пузырьков
профилин 15 запасение G-актина
миозин 2x260 скольжение нитей
скруин 102 акросома
вилин 92 микроворсинки
дематин 48 кортик сеть эритроцитов
фимбрин 68 адгезион. контакты, микроворсинки связ в пучки
актинин 2x102 адгез контакты, микроворсинки связ в пучки
спектрин 2x265+2x260 кортик сеть эритроц прикрепление к ПМ
дистрофин 427 корт.сеть мыш волокон
ABP120 92 псевдоподии
филамин 2x280 псевдоподии, стрессфибриллы сшивает в сети
микрофиламенты
d=6-8нм, актиновые нити | мономер G-актин (глобулярный актин)- ассиметричный
(42кДа) состоит из двух доменов, по мере повышения ионной силы агрегирует
в скрученный в спираль полимер F-актин (фибриллярный актин) | молекула
G-актина несет прочно связанную АТФ, кот при переходе в F-актин медленно
гидролизуется до АДФ – проявляет св-ва АТФ-азы | F-актин обладает полярностью
(+) и (-) | при критических конц G-актина (+) конец удлиняется, а (-)
– укорачивается | фаллоидин – яд бледной поганки связывается с (-) концом
и ингибирует деполяризацию, цитохалазин – токсин плесневых грибов присоед
к (+) концу, блокируя полимеризацию | более 50 белков в цитоплазме связываются
с актином -ф-ции: регулируют объем G-актинового пула (профилин), влияют
на скорость полимеризации (виллин), стабилизируют концы нитей (фрагин,
-актинин), сшивают филаменты др с др или с др компонентами (виллин, -актин,
спектрин, MARCKS, фимбрин), разрушают двойную спираль F-актина (гельзолин).
Активность этих белков регулируется Ca2+ и протеинкиназами |
ПРОМЕЖУТОЧНЫЕ ФИЛАМЕНТЫ
белки промеж филаментов клетки число M, kD тип
кислые кератины эпит >15 40-57 I
основные кератины эпит >15 53-67 II
десмин мыш 1 53 III
кислый фибриллярный белок глиальн, астроциты 1 50
виментин мезенх, нек эпит 1 57
периферин нервные 1 57
белки нейрофиламентов: аксоны и дендриты IV
NF-L 1 62
NF-M 1 102
NF-H 1 110
интернексин ЦНС 1 66
нестин эпит нервн ткани 1 240
ламин A ядра всех клеток 1 70 V
ламин B 1 67
ламин С 1 67
септамерный мономер?параллельный димер?антипараллельный тетрамер?протофиламент?
протофибрилла?ПФ
промежуточные филаменты
d=10нм, (цитокератины, десмин, виментин, кислый фибриллярный глиапротеин
(GFAP), нейрофиламент) состоят из базовой стержневой стр-ры – суперспирализованная
-спираль, такие димеры ассоциируют антипараллельно, образуя тетрамер,
агрегация тетрамеров «голова к голове» дает протофиламент, 8 протофиламентов
образ. промежуточное волокно | полимеризация ведет к образ. устойчивых
неполярных полимерных молекул
белки связанные с ПФ
белок M, kD локализация
BPAG1 230 полудесмосомы
плакоглобин 3 десмосомы
десмоплакинI 250 десм
десмоплакинII 215 десм
плектин 300 кортек. зона
анкирин 140 кортек. зона
филаггрин 30 цитозоль
рецептор B-ламина 58 ядро
У мутантов мышей отсутствует виментин, мыши при этом живут совершенно
нормально.
В растительных клетках цитоскелет представлен микротрубочками и микрофиламентами,
промежуточных филаментов нет, но есть ламины
МИКРОТРУБОЧКИ
фосфорилирование тубулина усиливает полимеризацию
d=25нм, тубулин - димер - и -субъединиц (53 и 55 кДа), образуют линейные
цепочки – протофиламенты, 13 протофиламентов образуют циклический комплекс,
кольца полимеризуются в трубку. Субъединицы тубулина связывают ГТФ. Динамические
полярные стр-ры (+)-динамически нестабильный и (-)-конец стабилизируется,
связываясь с центросомой (центр организации микротрубочек). Тубулиновые
мономеры связывают ГТФ, кот медленно гидролизуется до ГДФ | с микротрубочками
ассоциируют два вида белков: стр-рные белки (MAP-microtubuls-associated
proteins) и белки транслокаторы | ассоциация подавляется винбластин, винкристин,
колхицин, усиливается – таксол | Гамма-сома – микротрубочко организующий
центр на внешней пов-ти ядра
время полужизни мт ~5мин, во время первой половины митоза ~15c
Reference.
Suvar
June 13, 2006 20:04
Свои пожелания отправляйте по адресу
drosophila.narod.ru
Жизнь коротка, наука вечна
Наука нам сокращает опыты быстротекущей жизни. ( А.С. Пушкин)