Теломеры
Оглавление.
Теломеры дрожжей
Теломеры дрозофилы
Reference
Теломеры - концевые участки хромосом.
Теломерные последовательности у разных организмов.
TTAGGG - Human, mouse, Xenopus, Neurospora crassa,
Physarum, Didymium, Trypanosoma, Crithidia, Aloe, Asparagus
AG(1-8) - Dictyostelium
TTGGGG - Tetrahymena, Glaucoma
TTGGG(T/G) - Paramecium
TTTTGGGG - Oxytricha, Stylonychia, Euplotes
TTAGGG(T/C) - Plasmodium
TTTAGGG - Arabidopsis thaliana
TTTTAGGG - Chlamydomonas
TTAGG - Bombyx mori
TTAGGC - Ascaris lumbricoides
TTAC(A)(C)G(1-8) - Schizosaccharomyces pombe
TG(2-3)TG(1-6) - Sc
TTAGGC - Caenorhabditis elegans
Теломеры человека.
Повторы TTAGGG соединяется с белками: TRF1, TRF2, TIN2, Rap1,
TPP1, POT1, называемые шелтеринами.
TRF1, TRF2 и POT1 напрямую узнают TTAGGG повторы. Эти белки сцепляются
с тремя другими белками - TIN2, Rap1 и TPP1 формируя комплекс, отличающий
теломеры от сайтов повреждения ДНК. TRF1 и TRF2 формируют гомодимеры,
POT1 связывает одноцепочечный сайт 5'-(T)TAGGGTTAG-3' (рис.1)
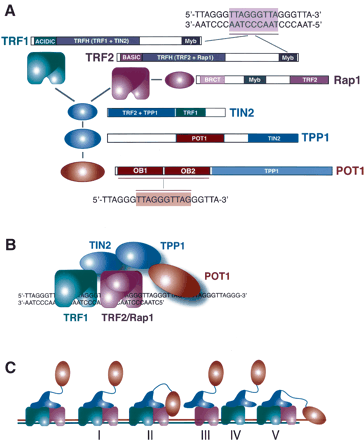
рис.1 Белки шелтерины. (A) Домены белков и их взаимодействие
с другими белками и ДНК. (B) Сборка комплекса на теломере. (С) Различные
субкомплексы и возможные их взаимодействия с теломерной ДНК.
Шелтерины формируют защитный комплекс на конце теломеры, участвуют в образовании Т-петли и контролируют синтез теломерной ДНК при участии теломеразы (рис.2).
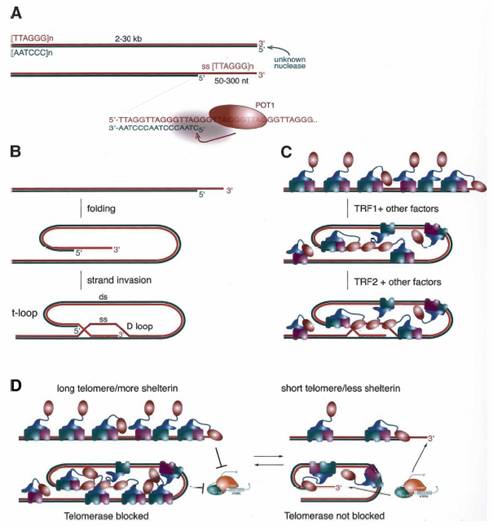
рис.2 (А) Образование конца теломеры. (В) Образование Т-петли.
(С) Предполагаемое участие шелтеринов в формировании Т-петли. (D) Модель
удлинения теломеры.
Теломеры дрожжей.
У дрожжей, как и у большинства эукариот теломеры состоят из G-богатых
повторов. 3'-конец теломеры выступает в виде одноцепочечного фрагмента.
Silent information regulator (Sir) - белок предотвращающий молчание генов
вблизи теломер
Sir2 - гистон деацетилаза, связывается с ацетилированными N-концами гистонов.
В отличие от большинства деацетилаз Sir2 использует NAD+ как кофактор
Теломеры дрозофилы.
Дрозофила лишена типичных для большинства организмов теломер, не смотря
на то, что они были открыты именно на плодовой мушке. У дрозофилы отсутствует
теломераза и удлинение теломер происходит путем перемещения транспозонов.
Теломеры состояти из субтеломерных сателлитных повторов ДНК TAS и концевого
набора, состоящего из трех ретротранспозонов без LTR: HeT-А, TAHRE и TART.
TAS (Telomere-associated satellite) - сателлиты длинной 400 пн - 1,8 тпн,
занимают несколько килобаз ДНК.
TART имеет две рамки считывания ORF1 и ORF2 называемые gag и pol за свое
сходство с белками ретровирусов (см. обзор Вирусы).
ORF2 TART кодирует протеазу и RT - обратную транскриптазу. у HeT-A отсутствует
ORF2 и RT кодируется в каком-то другом месте. HeT-A и TART имеют длинные
3'-UTR, причем у HeT-A состоящий из несовершенных повторов. Для транскрипции
HeT-A необходим промотор располагающийся в 3' UTR предыдущего элемента.
HeT-A транскрибируется в нормальном 5'-->3' направлении, а TART в смысловом
и антисмысловом. Функция антисмыслового транскрипта не известна. HeT-A
в несколько раз больше, чем TART. Они случайно перемешаны и располагаются
друг за другом. Фрагменты этих повторов встречаются в прицентромерном
гетерохроматине и никогда не встречаются в эухроматине.
Особенностью HeT-A и TART является их высокая изменчивость у разных видов
дрозофил. HeT-A D.yakuba имеет только 55% гомологии с D.melanogaster.
Теломера теряет ~75 пн за один раунд репликации и восстанавливается за
счет перемещения транспозонов TART, TAHRE и HeT-A.
Концы политенных хромосом морфологически различаются у разных линий дрозофил.
Обнаружено, что удлинение хромосом связано с накоплением TART и HeT-A.
Мутации генов E(tc) и HP1 связаны с изменением длины теломер.
Белки участвующие в образовании теломер и белки регуляторы: HOAP, HP1,
Rad50, Mre11, UbcD1 (гомолог E2), Ku70/80 (гетеродимер). Концевой кепирующий
комплекс дрозофилы образуется вне зависимости от состава ДНК. HP1 связывается
с одноцепочечной ДНК, к нему присоединяется HOAP.
Сокращения.
LTR (Long Terminal Repeat) - длиный концевой
повтор.
UTR (Untranslated Region) - нетранслируемая область.
E(tc) - Enchaser of terminal-gene conversion.
Reference.
de Lange
T. (2005) Shelterin: the protein complex that shapes and safeguards human
telomeres. Genes Dev. 19(18):2100-10. Review.
Свои пожелания отправляйте по адресу
drosophila.narod.ru
Жизнь коротка, наука вечна
Наука выигрывает, когда ее крылья раскованы фантазией. (М.Фарадей)